
当水的温度降低到0摄氏度的时候,它就开始结冰了,但是冬天里无论都寒冷,酒精都是不会结冰的。实际上并不仅仅是酒精,是绝大多数的醇类都很难凝结成固体,这些有机分子倾向于保持液态。那么为什么酒精之类的物质不容易结冰呢?

为什么液体会变成固体?
不管什么物质,都会有液体和固体状态,从液体变成固体则被称为是凝固,但是是什么导致液体会变成固体呢?
每一种化合物都有一些内能,这取决于它周围的温度。这种内部能量控制着物质存在的状态。当化合物周围的温度降低时,化合物可用的内部能量也会减少。这导致分子间力的增加。

当热量被移除时,化合物的分子会靠得更近。这就是为什么许多液体在低温下开始凝固的原因。但是,不同的液体有不同的凝固点。
液体的凝固点是液体转变为固态的温度。水的凝固点为0°C,而乙醇(也就是酒精)的凝固点为-114°C。这意味着让酒精变成固体,那么必须要将酒精的温度降低到零下114摄氏度的时候。
水和酒精这两种液体凝固点的巨大差异是由于它们分子间作用力的巨大差异造成的。水分子之间的结合比乙醇分子更紧密。
分子间作用力和氢键
分子间力有助于将分子彼此结合,因此它们不会分离。气体具有最低的分子间力,而固体具有最高的分子间力。对此的解释相当简单。液态分子间的分子间作用力小于固态,但大于气体。
这些力取决于分子之间的距离。该距离在气体中最高,在固体中最低。分子间作用力也取决于分子的性质。因此,一些分子固有地具有更大的分子间力。
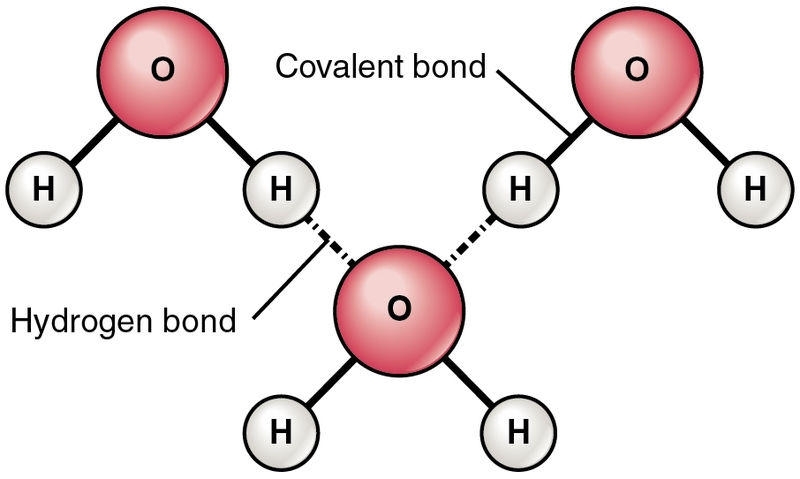
显示出强大分子间作用力的最重要的键称为氢键。一个水分子的氢原子与另一个分子的氧原子形成分子间氢键。有时,氢原子会形成更强的键,这取决于它们所连接的原子。
水和乙醇分子中的氢键比较
让我们先看一下水分子的结构:
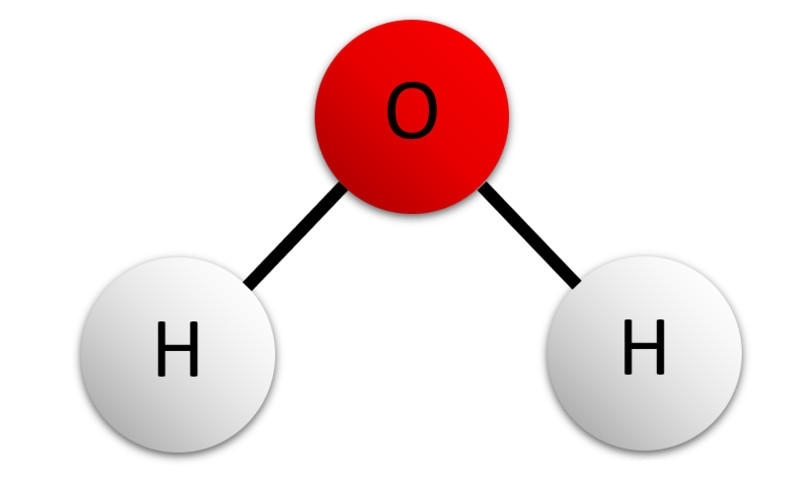
在这里,你可以看到一个氧原子与两个氢原子结合。现在,这两个氢原子必须与另一个分子的氧结合,从而产生如下结构:
现在,让我们看看乙醇分子的样子:
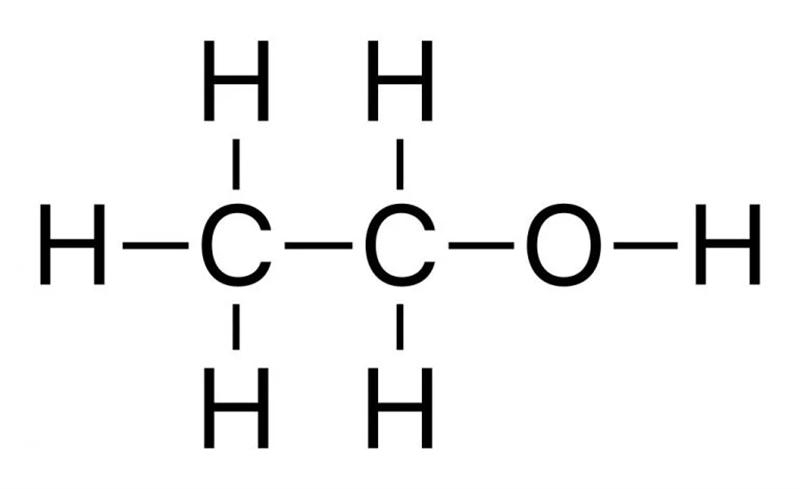
乙醇分子有两个相互连接的碳原子。每个碳原子可以再形成三个键。第一个碳有三个氢,而第二个有两个氢和一个醇(-OH)基团。正是这个-OH基团形成了醇分子之间的氢键。
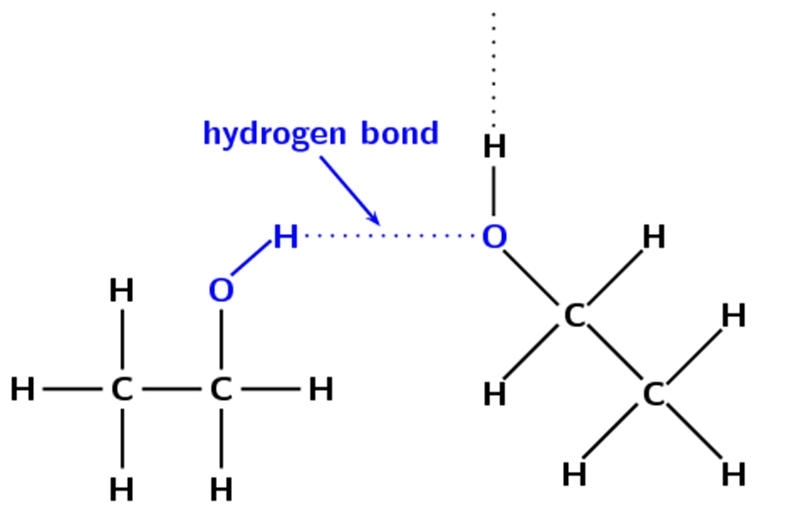
但是,由于氧与碳相连,因此氧的极性下降。这里的极性是原子在中性分子中拥有的负电荷或正电荷的数量。
分子中的原子极性越大,分子的极性就越大。在这里,水的极性比乙醇强得多,这就是水中的氢键强得多的原因。
物质的分子极性是如何影响凝固的?
回到我们最初的问题:为什么酒精难以凝结成固体?我们知道醇的极性很小,或者是非极性的。单个乙醇分子之间的分子间作用力非常低。
由于这些分子间作用力很低,因此分子倾向于彼此远离。在分子聚集在一起之前,化合物不能以固态存在。
酒精分子不会自行聚集在一起。固化化合物需要极低的温度。简而言之,分子之间缺乏吸引力使得酒精很难结冰。
结论
与水等液体相比,冷冻酒精要困难得多。而普通家用冰箱的冷冻温度一般也只有-20℃,这样的温度是远远不足以将酒精冻结起来的。
这是因为乙醇是一种有机非极性化合物,不能形成强氢键。这会影响分子间作用力并使其变弱。由于氢键和分子间作用力较弱,乙醇分子拒绝合作并结合在一起。
这导致化合物具有更高的能量,因此需要更低的温度才能固化。这就是为什么酒精很难冷冻的原因!


还有一个融化的木头